2023年1月27日,浙大城市学院医学院张凌宵副教授和曾玲晖教授团队在药学TOP期刊《Journal of Controlled Release》(IF = 11.467,中科院1区)上发表了题为Engineered NanoAlum from aluminum turns cold tumor hot for potentiating cancer metalloimmunotherapy的研究性论文,该工作首次以临床铝佐剂为原型,设计并构建了一种含有镁离子且呈弱碱性的新型纳米铝佐剂(NanoAlum),发现瘤周注射NanoAlum能够有效抑制实体瘤的生长,为肿瘤新辅助治疗提供了新思路(图1)。该工作主要依托浙江省神经损伤修复新靶点及药物研究重点实验室完成。
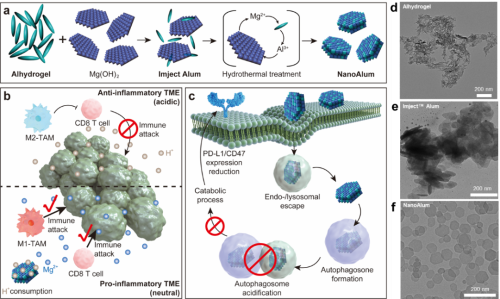
图1. NanoAlum抑制实体瘤生长作用机制示意图
免疫抑制性肿瘤微环境(TME)是限制肿瘤免疫疗效的主要原因。尽管以免疫检查点抗体和细胞因子为代表的生物制剂已被开发并应用于TME调控,但其副反应较大。同时,新近研究的多功能纳米制剂,存在剂型复杂且临床转化困难的问题。因此,开发组分简单且安全高效的TME免疫调节剂,对提升肿瘤免疫疗效具有重要意义。
铝佐剂(AlOOH)是临床上最广泛使用的疫苗佐剂,能够有效辅助抗原诱导抗体免疫应答,但无法诱导T细胞免疫应答。商业化铝佐剂Imject Alum在AlOOH中加入氢氧化镁,发现能够促使免疫应答向Th1极化(有利于诱导T细胞免疫应答)。在此基础上,团队首次采用水热处理的方式对Imject Alum进行再加工,获得了与其化学成分几乎完全一致的NanoAlum。相对而言,NanoAlum具有更小的粒径(92 nm)、明确的层状晶体结构、且低浓度溶液即呈弱碱性(pH~9)。体内研究表明,NanoAlum在中和酸性肿瘤组织的同时能够释放大量Mg2+,随后募集并激活瘤内T细胞从而显著地抑制小鼠黑色素瘤和结肠癌的生长(图2)。
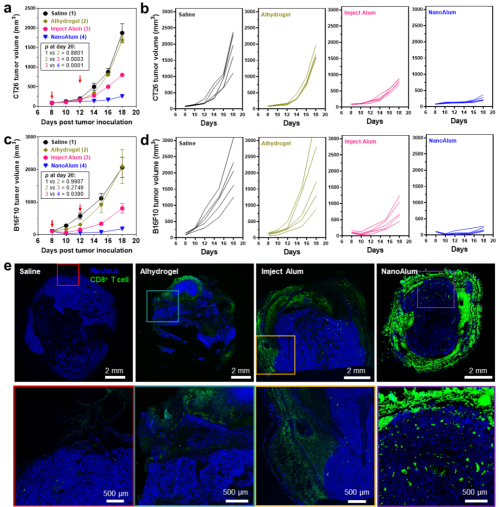
图2. NanoAlum抑制小鼠实体瘤生长并促使T细胞向瘤内浸润
针对注射途径对NanoAlum抗瘤疗效的影响发现,采用瘤内注射的NanoAlum受注射剂量及TME快速代谢的影响,无法有效抑制肿瘤生长。相对地,当NanoAlum采用瘤旁注射时则能够持续驻留在肿瘤周围,有效地抑制肿瘤生长。这种抑制效果,随着NanoAlum注射位点与肿瘤边缘距离的增大(远端注射)而减小。此外,胶体稳定性的提高对NanoAlum的抑瘤疗效并无明显作用。当NanoAlum使用牛血清白蛋白(BSA)包被后其体内分散性显著提高。然而,在相同的注射方式下,裸露的NanoAlum较BSA/NanoAlum具有更高的抑瘤疗效,这与BSA/NanoAlum在皮下组织中快速扩散与清除有关。
尽管NanoAlum能够有效抑制实体瘤的生长,但免疫学研究发现,NanoAlum无法诱导有效的保护性免疫应答。为了解决这一问题,团队进一步设计了含有FDA批准药物氨甲蝶呤(MTX)或分子佐剂CpG的功能化纳米佐剂。当采用远端注射来对实体瘤进行治疗时,NanoAlum/MTX能够有效杀伤肿瘤细胞,随后死亡肿瘤细胞释放的抗原被NanoAlum/CpG捕获后被进一步呈递到免疫系统来诱导抗原特异性保护性免疫应答。
贾英勃博士生、胡静博士和朱超杰博士生为本文共同第一作者。浙大城市学院医学院张凌宵副教授和曾玲晖教授为共同通讯作者。本研究受国家自然科学基金等资助。
原文链接
https://www.sciencedirect.com/science/article/abs/pii/S0168365923000524
转自/浙大城市学院医学院