近日,浙大城市学院医学院衰老与肿瘤研究中心在《Advanced Science》(IF = 17.521,Q1)上发表了题为Emerging implications of phase separation in cancer的综述论文,对蛋白相变相关最新概念及其在癌症中的作用进行了全面地论述。
在真核细胞中,生命活动被有序地分配一个个细胞区室或细胞器中完成。典型的有膜的细胞器已经被广泛研究,然而细胞中还存在着丰富的,功能多样的无膜细胞器(MLOs)。近十年来,随着实验方法和技术的进步,有关MLOs的研究蓬勃发展,这加深了我们对MLOs的不同组成和功能的理解。MLOs在细胞形成、信号转导、核糖体生物合成、有丝分裂和不对称分裂等生物过程中发挥着重要作用。被称为液-液相分离(LLPS)的生物物理过程阐明了动态的生物分子组装是如何形成MLOs。蛋白质,DNA,RNA可以驱动LLPS的形成。同时,大量研究也表明LLPS功能障碍引起的异常蛋白质聚集是癌症中的一个关键诱因。因此,深刻地理解与癌症相关的相分离和凝聚,将会给我们提供全新的癌症治疗思路和手段。
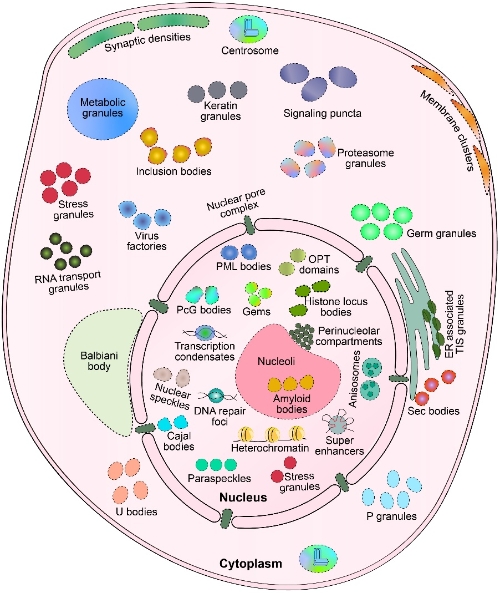
综述主要介绍了以下四个方面:1)描述了LLPS的相关概念及其是如何促进无膜细胞器的形成。2)介绍了最近的关于LLPS调控的理解。3)讨论了LLPS/MLOs是如何参与到癌症病理当中。4)设想了干扰异常的LLPS/MLOs的可行性手段。细胞中的蛋白质、DNA和RNA可以介导低亲合力的分子间或分子内相互作用,从而触发相分离。相分离或MLOs的形成对物理化学诱因极其敏感。即使是MLOs关键组成成分的局部丰度、翻译后修饰(PTMs)、RNA修饰、能量输入或物理化学条件(pH、盐离子强度、温度)等的微小变化,也会对相分离的特征产生显著的调节作用。一些癌细胞的典型特征包括持续的增殖信号、逃避生长抑制、抵抗细胞死亡、血管形成、组织浸润侵袭等现象,异常的LLPS水平已经被用于解释这些表型发生的机制。文章设想了全新的基于相分离的癌症治疗方法,包括干扰凝聚体的形成以及对凝聚体组分进行靶向修饰等。
文章最后还指出,现如今大多数关于细胞内相分离的研究都聚焦于描述其现象和生物学功能,而不是着力于探索最基础的物理化学过程,因此,我们还远未理解这个神秘的复合物。当然,研究过程中的一些方法技术的限制和挑战是阻碍我们进一步理解细胞内生物大分子凝聚的重要原因。我们需要提出新的方法,创造出新的工具,比如能够诱导、抑制或者改变特定凝聚体的物理化学性质的探针,来进行研究。可以预见,当我们深刻理解了与癌症相关的相分离和凝聚之后,将会在癌症的治疗方法上产生革命性的变化。
参考文献:Ren J, Zhang Z, Zong Z, Zhang L, Zhou F. Emerging Implications of Phase Separation in Cancer. Adv Sci. 2022 Sep 18;e2202855. doi: 10.1002/advs.202202855.
转自/浙大城市学院医学院